¿Qué es una reacción química?
Las reacciones químicas (también llamadas cambios químicos o fenómenos químicos) son procesos termodinámicos de transformación de la materia. En estas reacciones intervienen dos o más sustancias (reactivos o reactantes), que cambian significativamente en el proceso, y pueden consumir o liberar energía para generar dos o más sustancias llamadas productos.
Toda reacción química somete a la materia a una transformación química, alterando su estructura y composición molecular (a diferencia de los cambios físicos que sólo afectan su forma o estado de agregación). Los cambios químicos generalmente producen sustancias nuevas, distintas de las que teníamos al principio.
Las reacciones químicas pueden darse de manera espontánea en la naturaleza (sin que intervenga el ser humano), o también pueden ser generadas por el ser humano en un laboratorio bajo condiciones controladas.
Muchos de los materiales que empleamos a diario son obtenidos industrialmente a partir de sustancias más simples combinadas mediante una o diversas reacciones químicas.
Cambios físicos y químicos en la materia
Los cambios físicos de la materia son aquellos que alteran su forma sin cambiar su composición, es decir, sin modificar el tipo de sustancia del que se trata.
Estos cambios tienen que ver con los cambios de estado de agregación de la materia (sólido, líquido, gaseoso) y otras propiedades físicas (color, densidad, magnetismo, etc).
Los cambios físicos suelen ser reversibles ya que alteran la forma o el estado de la materia, pero no su composición. Por ejemplo, al hervir agua podremos convertir un líquido en un gas, pero el vapor resultante sigue compuesto por moléculas de agua. Si congelamos el agua, pasa al estado sólido pero igualmente sigue siendo químicamente la misma sustancia.
Los cambios químicos alteran la distribución y los enlaces de los átomos de la materia, logrando que se combinen de manera distinta obteniéndose así sustancias diferentes a las iniciales, aunque siempre en una misma proporción, pues la materia no puede crearse ni destruirse, sólo transformarse.
Por ejemplo, si hacemos reaccionar agua (H2O) y potasio (K), obtendremos dos sustancias nuevas: hidróxido de potasio (KOH) e hidrógeno (H2). Esta es una reacción que normalmente libera mucha energía y, por tanto, es muy peligrosa.
Características de una reacción química
Las reacciones químicas son generalmente procesos irreversibles, es decir, involucran la formación o destrucción de enlaces químicos entre las moléculas de los reactivos, generando una pérdida o ganancia de energía.
En una reacción química la materia se transforma profundamente, aunque en ocasiones esta recomposición no pueda apreciarse a simple vista. Aun así, las proporciones de los reactivos pueden medirse, de lo cual se ocupa la estequiometría.
Por otro lado, las reacciones químicas generan productos determinados dependiendo de la naturaleza de los reactivos, pero también de las condiciones en que la reacción se produzca.
Otra cuestión importante en las reacciones químicas es la velocidad a la que ocurren, ya que el control de su velocidad es fundamental para su empleo en la industria, la medicina etc. En este sentido, existen métodos para aumentar o disminuir la velocidad de una reacción química.
Un ejemplo es el empleo de catalizadores, sustancias que aumentan la velocidad de las reacciones químicas. Estas sustancias no intervienen en las reacciones, sólo controlan la velocidad a la que ocurren. También existen sustancias llamadas inhibidores, que se emplean de la misma forma pero provocan el efecto contrario, es decir, disminuyen la velocidad de las reacciones.
¿Cómo se representa una reacción química?
Las reacciones químicas se representan mediante ecuaciones químicas, es decir, fórmulas en las que se describen los reactivos participantes y los productos obtenidos, a menudo indicando determinadas condiciones propias de la reacción, como la presencia de calor, catalizadores, luz etc.
La primera ecuación química de la historia fue redactada en 1615 por Jean Beguin, en uno de los primeros tratados sobre química, el Tyrocinium Chymicum. Hoy son de enseñanza común y gracias a ellas podemos visualizar con mayor facilidad lo que está ocurriendo en una reacción determinada.
La forma general de representar una ecuación química es: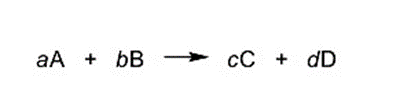
Donde:
- A y B son los reactivos.
- C y D son los productos.
- a, b, c y d son los coeficientes estequiométricos (son números que indican la cantidad de reactivos y productos) que deben ser ajustados de manera que haya la misma cantidad de cada elemento en los reactivos y en los productos. De esta forma se cumple la Ley de Conservación de la Masa (que establece que la masa no se crea ni se destruye, solo se transforma).
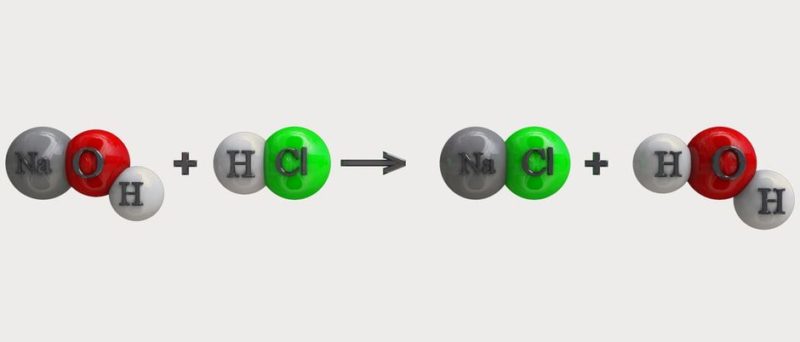
Tipos y ejemplos de reacciones químicas
Las reacciones químicas pueden clasificarse según el tipo de reactivos que reaccionan. En base a esto, se pueden distinguir reacciones químicas inorgánicas y reacciones químicas orgánicas. Pero antes, es importante conocer algunos de los símbolos que se utilizan para representar dichas reacciones mediante ecuaciones químicas: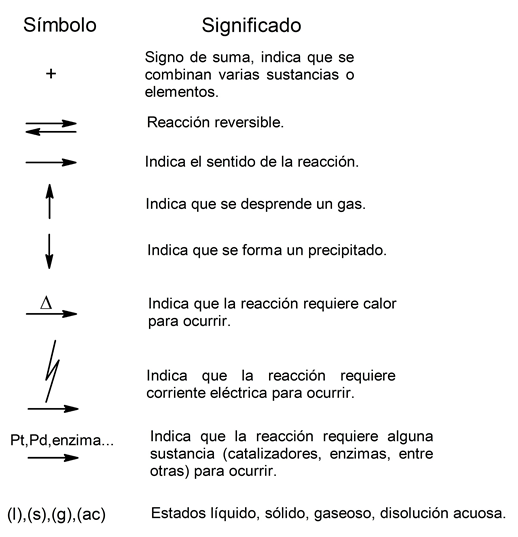
Reacciones inorgánicas. Involucran compuestos inorgánicos, y pueden ser clasificadas de la siguiente forma:
- Según el tipo de transformación.
- Reacciones de síntesis o adición. Dos sustancias se combinan para dar como resultado una sustancia diferente. Por ejemplo:
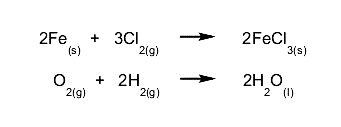
- Reacciones de descomposición. Una sustancia se descompone en sus componentes simples, o una sustancia reacciona con otra y se descompone en otras sustancias que contienen los componentes de esta. Por ejemplo:
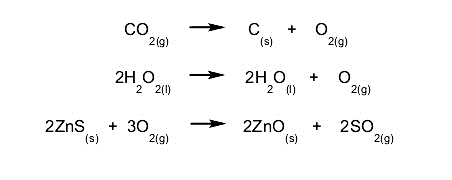
- Reacciones de desplazamiento o sustitución. Un compuesto o elemento ocupa el lugar de otro en un compuesto, sustituyéndolo y dejándolo libre. Por ejemplo:
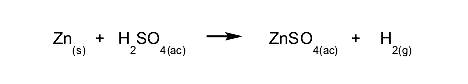
- Reacciones de doble sustitución. Dos reactivos intercambian compuestos o elementos químicos simultáneamente. Por ejemplo:
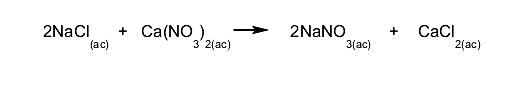
- Reacciones de síntesis o adición. Dos sustancias se combinan para dar como resultado una sustancia diferente. Por ejemplo:
- Según el tipo y la forma de la energía intercambiada.
- Reacciones endotérmicas. Se absorbe calor para que la reacción pueda ocurrir. Por ejemplo:
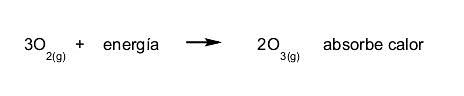
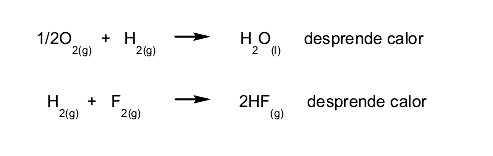
- Reacciones exotérmicas. Se desprende calor cuando la reacción ocurre. Por ejemplo:
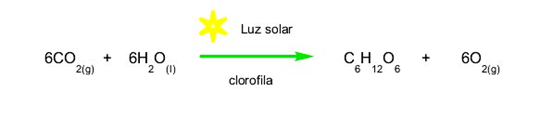
- Reacciones endoluminosas. Se necesita luz para que ocurra la reacción. Por ejemplo: la fotosíntesis.
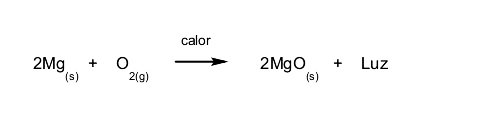
- Reacciones exoluminosas. Se desprende luz cuando ocurre la reacción. Por ejemplo:
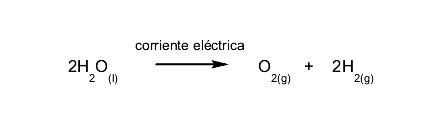
- Reacciones endoeléctricas. Se necesita energía eléctrica para que la reacción ocurra. Por ejemplo:
- Reacciones exoeléctricas. Se desprende o se genera energía eléctrica cuando ocurre la reacción. Por ejemplo:
- Reacciones endotérmicas. Se absorbe calor para que la reacción pueda ocurrir. Por ejemplo:
- Según la velocidad de reacción.
- Reacciones lentas. La cantidad de reactivos consumidos y la cantidad de productos formados en un tiempo determinado es muy poca. Por ejemplo: la oxidación del hierro. Es una reacción lenta, que vemos cotidianamente en los objetos de hierro que están oxidados. Si no fuese lenta esta reacción, no tendríamos estructuras de hierro muy antiguas en el mundo actual.
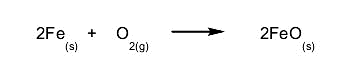
- Reacciones rápidas. La cantidad de reactivos consumidos y la cantidad de productos formados en un tiempo determinado es mucha. Por ejemplo: la reacción del sodio con el agua es una reacción que además de ocurrir rápidamente es muy peligrosa.

- Reacciones lentas. La cantidad de reactivos consumidos y la cantidad de productos formados en un tiempo determinado es muy poca. Por ejemplo: la oxidación del hierro. Es una reacción lenta, que vemos cotidianamente en los objetos de hierro que están oxidados. Si no fuese lenta esta reacción, no tendríamos estructuras de hierro muy antiguas en el mundo actual.
- Según el tipo de partícula involucrada.
- Reacciones ácido-base. Se transfieren protones (H+). Por ejemplo:
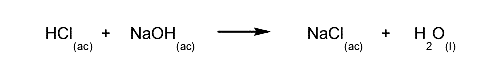
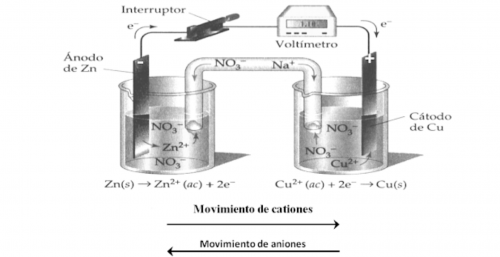
- Reacciones de oxidación-reducción. Se transfieren electrones. En este tipo de reacción debemos fijarnos en el número de oxidación de los elementos involucrados. Si el número de oxidación de un elemento aumenta, este se oxida, si disminuye, este se reduce. Por ejemplo: en esta reacción se oxida el hierro y se reduce el cobalto.
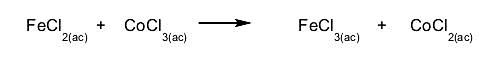
- Reacciones ácido-base. Se transfieren protones (H+). Por ejemplo:
- Según el sentido de la reacción.
- Reacciones reversibles. Se dan en ambos sentidos, es decir, los productos pueden volver a convertirse en los reactivos. Por ejemplo:
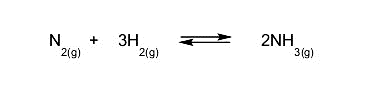
- Reacciones irreversibles. Se dan en un solo sentido, es decir, los reactivos se transforman en productos y no puede ocurrir el proceso contrario. Por ejemplo:
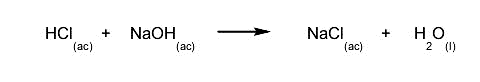
- Reacciones reversibles. Se dan en ambos sentidos, es decir, los productos pueden volver a convertirse en los reactivos. Por ejemplo:
Reacciones orgánicas. Involucran compuestos orgánicos, que son los que están relacionados con la base de la vida. Dependen del tipo de compuesto orgánico para su clasificación, ya que cada grupo funcional posee un rango de reacciones específicas. Por ejemplo, los alcanos, alquenos, alquinos, alcoholes, cetonas, aldehídos, éteres, ésteres, nitrilos, etc.
Algunos ejemplos de reacciones de compuestos orgánicos son:
- Halogenación de alcanos. Se sustituye un hidrógeno del alcano por el halógeno correspondiente.
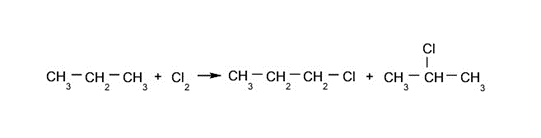
- Combustión de alcanos. Los alcanos reaccionan con el oxígeno para dar dióxido de carbono y agua. Este tipo de reacción libera gran cantidad de energía.
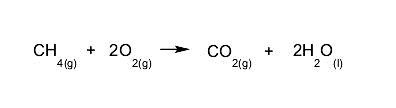
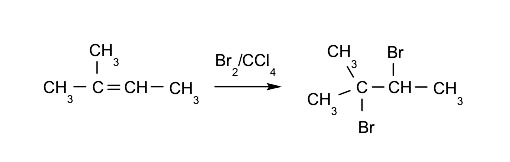
- Halogenación de alquenos. Se sustituyen dos de los hidrógenos presentes en los carbonos que forman el doble enlace.
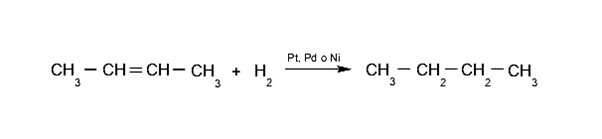
- Hidrogenación de alquenos. Se agregan dos hidrógenos al doble enlace, de esta forma se produce el alcano correspondiente. Esta reacción ocurre en presencia de catalizadores como platino, paladio o níquel.
Importancia de las reacciones químicas
Las reacciones químicas son fundamentales para la existencia y comprensión del mundo tal y como lo conocemos. Los cambios que la materia sufre en condiciones naturales o creadas por el hombre (y que a menudo generan materiales valiosos) son solo un ejemplo de ello. La evidencia más grande de la importancia de las reacciones químicas es la propia vida, en todas sus expresiones.
La existencia de seres vivos de todo tipo es únicamente posible gracias a la capacidad de reacción de la materia, que permitió a las primeras formas celulares de vida intercambiar energía con su entorno mediante rutas metabólicas, o sea, mediante secuencias de reacciones químicas que arrojaban más energía útil de la que consumían.
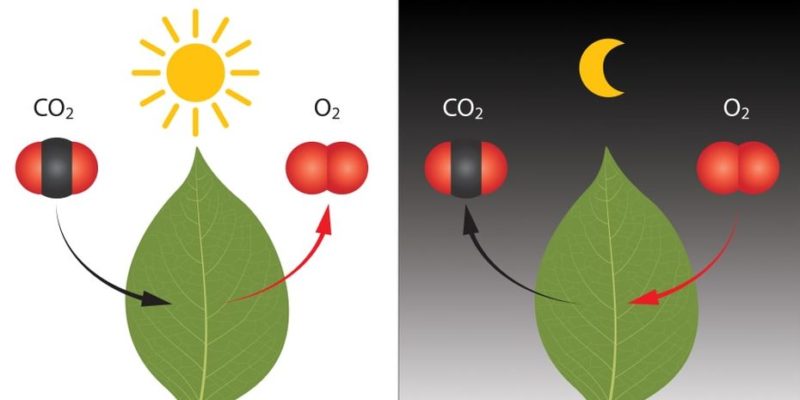
Por ejemplo, en nuestra vida diaria la respiración está compuesta por múltiples reacciones químicas, que también están presentes en la fotosíntesis de las plantas.
Velocidad de una reacción química
Las reacciones químicas requieren de un tiempo estipulado para suceder, el cual varía dependiendo de la naturaleza de los reactivos y del entorno en el que la reacción se produzca.
Los factores que afectan la velocidad de las reacciones químicas por lo general suelen ser:
- Aumento de temperatura. Las altas temperaturas tienden a aumentar la velocidad de las reacciones químicas.
- Aumento de la presión. Al aumentar la presión se suele aumentar la velocidad de las reacciones químicas. Esto ocurre generalmente cuando reaccionan sustancias que son sensibles a los cambios de presión, como son los gases. En el caso de líquidos y sólidos, los cambios de presión no provocan cambios importantes en la velocidad de sus reacciones.
- Estado de agregación en que se encuentren los reactivos. Los sólidos suelen reaccionar más lentamente que los líquidos o los gases, aunque la velocidad también dependerá de la reactividad de cada sustancia.
- Empleo de catalizadores (sustancias que se emplean para aumentar la velocidad de las reacciones químicas). Estas sustancias no intervienen en las reacciones, solo controlan la velocidad a la que ocurren. También existen sustancias llamadas inhibidores, que se emplean de la misma forma pero provocan el efecto contrario, es decir, disminuyen la velocidad de las reacciones.
- Energía luminosa (Luz). Algunas reacciones químicas son aceleradas cuando se les hace incidir luz.
- Concentración de los reactivos. La mayoría de las reacciones químicas ocurren más rápido si tienen una alta concentración de sus reactivos.
Fuente: https://concepto.de/reaccion-quimica/#ixzz7jcPdH2H0
No hay comentarios:
Publicar un comentario